Thymectomie
La thymectomie est l'ablation chirurgicale du thymus, pour traiter le plus souvent un thymome ou une myasthénie. Elle relève du domaine de la chirurgie thoracique.
Histoire[modifier | modifier le code]
Les première thymectomies ont été réalisées par le chirurgien allemand Ernst Ferdinand Sauerbruch (1875 - 1951) en 1911 par une voie d'abord transcervicale[1]. En 1939, l'Américain Alfred Blalock et son équipe ont publié la première rémission de myasthénie après une thymectomie réalisée par sternotomie[2].
Voies d'abord utilisées[modifier | modifier le code]
Deux voies d'abord principales sont utilisées : la sternotomie (« thymectomie trans-sternale ») et la vidéothoracoscopie (« thymectomie vidéo-assistée », qui peut être pratiquée assistée par un robot[3]). D'autres abords mini-invasifs sont également décrits[4], notamment par voie cervicale[5],[6] ou , en particulier chez l'enfant, la médiastinoscopie[7]. Le terme « mini-invasif » désigne l'ensemble des techniques ne comportant pas de sternotomie ni d'écartement des côtes[4].
Le choix de la voie d'abord se fait selon les caractéristiques du thymome. Il n'existe pas d'étude randomisée comparant les deux techniques ; seules des comparaisons a posteriori sont disponibles en 2016[8].
La voie trans-sternale est longtemps restée la voie d'abord de référence ; encore aujourd'hui, on reconnaît l'excellente qualité de l'exposition de la loge thymique qu'elle permet, afin de réaliser un évidement complet de celle-ci[9]. Toutefois, le développement des techniques moins invasives a permis de diminuer les complications et la lourdeur de l'intervention tout en conservant une qualité de résection similaire[8],[10]. Les voies vidéo-assistées sont recommandées pour les thymomes de petite taille et de stade précoce[10], et permettent alors de diminuer la durée de séjour hospitalier, la douleur post-opératoire et d'avoir un meilleur résultat esthétique[8]. Il faut cependant noter que les patients bénéficiant d'une chirurgie vidéo-assistée sont sélectionnés justement pour le caractère moins avancé du thymome[11]. Le moindre taux de complications post-opératoires peut donc être simplement dû au fait qu'il s'agit de tumeurs techniquement plus facile à retirer, sans bénéfice propre à la technique[8].
-
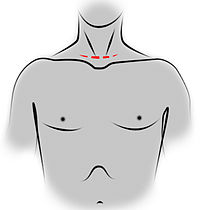
Incision de sternotomie médiane pour une thymectomie trans-sternale.
-
Incisions des orifices de trocarts pour une thymectomie vidéo-assistée par voie gauche.
-
Incision de cervicotomie pour une thymectomie trans-cervicale.
Sur le plan technique, chaque voie d'abord présente des avantages et des inconvénients. La voie trans-sternale est réalisée par une sternotomie médiane, la cicatrice parcourant toute la hauteur du sternum. On s'expose ainsi au risque d'infection du sternum, et toute la cavité pleurale n'est pas facilement accessible[9]. En revanche, il est facile d'étendre l'incision au cou, en cas d'une tumeur cervicothoracique, et de réaliser une exérèse devant emporter les organes adjacents : pneumonectomie ou lobectomie pulmonaire et geste sur les gros vaisseaux du médiastin ne sont possibles de manière optimale que par cette voie d'abord[9]. Par ailleurs, il est possible d'explorer les deux cavités pleurales, tout au moins dans leurs régions médiales. En cas d'envahissement local des organes voisins, il est en effet recommandé de réaliser une résection monobloc de la tumeur et des organes envahis[9].
La voie vidéothoracoscopique et la voie robotique sont très similaires[3], la chirurgie assistée par robot étant un prolongement technologique de la chirurgie vidéo où l'opérateur gagne simplement des degrés de liberté au niveau de la manipulation des instruments, qui se fait à partir d'une console située dans la salle d'intervention. Plutôt qu'à travers le sternum, le thymus est abordé par l'une des cavités pleurales. Un abord vidéothoracoscopique nécessite donc une ventilation unipulmonaire afin de dégager un espace de travail suffisant[3], et l'insufflation à faible pression de CO2 peut faciliter tant l'exposition que la dissection des structures[12].
Quelle que soit la voie d'abord retenue, en fin d'intervention d'une thymectomie radicale, la loge thymique doit être vide de toute graisse résiduelle[9].
Chirurgie des thymomes[modifier | modifier le code]
Indications[modifier | modifier le code]
Le traitement premier des thymomes est la résection chirurgicale complète.
Bien qu'il soit clair que le traitement chirurgical doive tendre à la résection la plus complète possible, l'intérêt d'une chirurgie de réduction de volume tumoral (« debulking ») fait débat[13]. Certains auteurs estiment qu'une résection incomplète suivie d'un traitement adjuvant à base de radio et de chimiothérapie permet une meilleure survie qu'un traitement purement médical. Toutefois, dans la plupart des études, le gain de survie est faible, et seules deux études ont montré un gain appréciable[14],[15]. Il est possible que le bénéfice retiré d'un debulking suivi d'un traitement adjuvant ne soit palpable qu'à moyen terme et disparaisse à long terme. Les études plus récentes, en revanche, ne concluent pas à un gain de survie significatif après debulking[16],[13],[17], préconisant un traitement par radiochimiothérapie seule à la place.
Afin de s'affranchir des biais méthodologiques liés au faible nombre de patients de ces études, une méta-analyse portant sur 13 études, pour un total de 314 patients, a été réalisée en 2015[18]. Les auteurs concluaient qu'un debulking pouvait améliorer le pronostic, mais avec des réserves liées à la méthodologie des études utilisées, au faible nombre de patients et une grande hétérogénéité des traitements adjuvants réalisés. Une autre réserve concerne l'envahissement des gros vaisseaux et la présence de métastases pleurales, qui ne semblent pas bénéficier d'un debulking.
Étendue de la résection[modifier | modifier le code]
Il existe actuellement un débat sur la possibilité de réaliser une simple thymomectomie (ablation du nodule thymique) plutôt qu'une thymectomie radicale (évidemment complet de la loge thymique) pour les thymomes de petite taille sans critères d'agressivité à l'imagerie. Chez les patients ne présentant pas de myasthénie, et dont le thymome est de petite taille, une thymomectomie seule semble acceptable, avec une survie à 5 ans identique. En revanche, on manque de données à long terme[19].
Dans certains cas, il convient de réaliser en plus un curage ganglionnaire[20]. Les tumeurs localement avancées, ainsi que les carcinomes thymiques, sont sources d'envahissement ganglionnaire, et l'intervention doit donc alors comporter un curage au moins paratrachéal droit et du médiastin antérieur[21]. C'est un geste qui peut être difficile par un abord vidéochirurgical, mais non par sternotomie, qui est la voie d'abord recommandée pour ce type de tumeurs plus agressives. L'intérêt du curage est principalement dans l'obtention d'un stade le plus fiable possible, permettant de guider le traitement post-opératoire[22].
Place de la thymectomie dans le traitement de la myasthénie[modifier | modifier le code]
L’intérêt clinique de la thymectomie en l’absence de thymome est encore discuté. Elle est cependant recommandée en cas de découverte d'une hyperplasie thymique avec présence d'anticorps anti-récepteurs à l'acétylcholine chez les patients de moins de 40 ans. Une étude randomisée de 2016 retrouve une amélioration clinique des symptômes de la myasthénie après thymectomie, même en absence d'hyperplasie thymique[23].
Gestion périopératoire d'une myasthénie associée[modifier | modifier le code]
Il n'existe pas de consensus international sur la gestion péri-opératoire de la myasthénie chez les patients opérés d'un thymome[24]. Cependant, une littérature médicale abondante existe sur le sujet, permettant à diverses sociétés savantes d'établir des recommandations[24],[25].
Des facteurs de risque de crise myasthénique en post-opératoire ont été identifiés[26], et comprennent la présence d'anticorps anti-récepteurs de l'acétylcholine, les histologies de type B1, B2 ou B3, et le caractère incomplet de la résection. Chez les patients présentant une myasthénie en pré-opératoire, une rechute de la myasthénie est possible jusqu'à deux ans après l'intervention[27] ; chez ces patients, une insuffisance respiratoire pré-opératoire est un facteur de risque de récidive de la myasthénie[27]. Cependant, le stress chirurgical seul est un facteur de risque de crise myasthénique[28].
Les médicaments anticholinestérasiques (pyridostigmine en particulier) sont souvent administrés en traitement de fond avant la chirurgie[24]. En revanche, en raison de leurs effets indésirables à type de vomissements et de troubles du rythme cardiaque, ils sont arrêtés le matin de la chirurgie[29]. La reprise, en général après le deuxième jour post-opératoire, doit être guidée par les symptômes et se faire de manière progressive[24].
Les corticoïdes oraux (notamment la prednisolone) font eux aussi souvent partie du traitement de fond des patients myasthéniques[24]. En raison de la majoration du risque de complications post-opératoires lié à la corticothérapie (difficultés de cicatrisation en premier lieu), en cas de myasthénie modérée, il est possible d'arrêter le traitement plusieurs semaines avant l'intervention[24]. Si le traitement anticholinestérasique est alors insuffisant à contrôler les symptômes, d'autres types de traitements peuvent être transitoirement réalisés, comme la plasmaphérèse[30], qui peut également être réalisée de principe indépendamment des symptômes[25]. Pour les patients qui ont reçu des corticoïdes à long terme avant la chirurgie, le traitement doit être repris précocement[30]. En cas de crise aiguë myasthénique en post-opératoire, il est possible de réaliser, avec précautions, de courtes corticothérapies intraveineuses à forte dose[31].
Dans le cas de myasthénies sévères, plusieurs séances de plasmaphérèse (3 à 5 en général) peuvent être réalisées avant l'intervention[25]. L'efficacité est observée en environ une semaine, et dure de 1 à 3 mois[24].
En absence de crise myasthénique sévère en post-opératoire, il n'est pas recommandé de traitement par immunoglobulines[24],[25].
Conséquences à moyen et long terme[modifier | modifier le code]
Les patients ayant eu une thymectomie ont plus de risque d'avoir un cancer ou une maladie auto-immune[32].
Références[modifier | modifier le code]
- (en) Marius Raica, Anca Maria Cimpean et Domenico Ribatti, « Myasthenia gravis and the thymus gland. A historical review », Clinical and Experimental Medicine, vol. 8, no 2, , p. 61-64 (DOI 10.1007/s10238-008-0158-y, lire en ligne
 , consulté le )
, consulté le )
- (en) Alfred Blalock, M. F. Mason, Hugh J. Morgan et S. S. Riven, « Myasthenia Gravis and Tumors of the Thymic Region - Report of a case in which the tumor was removed », Annals of Surgery, vol. 110, no 4, , p. 544-561 (PMCID PMC1391425, lire en ligne
 , consulté le )
, consulté le )
- Jens Rueckert, Marc Swierzy, Harun Badakhshi et Andreas Meisel, « Robotic-assisted thymectomy: surgical procedure and results », The Thoracic and Cardiovascular Surgeon, vol. 63, no 3, , p. 194–200 (ISSN 1439-1902, PMID 25806663, DOI 10.1055/s-0035-1549007, lire en ligne, consulté le )
- Alper Toker, « Standardized definitions and policies of minimally invasive thymoma resection », Annals of Cardiothoracic Surgery, vol. 4, no 6, , p. 535–539 (ISSN 2225-319X, PMID 26693149, PMCID 4669255, DOI 10.3978/j.issn.2225-319X.2015.10.02, lire en ligne, consulté le )
- Joseph B. Shrager, « Extended transcervical thymectomy: the ultimate minimally invasive approach », The Annals of Thoracic Surgery, vol. 89, no 6, , S2128–2134 (ISSN 1552-6259, PMID 20493996, DOI 10.1016/j.athoracsur.2010.02.099, lire en ligne, consulté le )
- Marcin Zieliński, Jarosław Kuzdzał, Artur Szlubowski et Jerzy Soja, « Transcervical-subxiphoid-videothoracoscopic "maximal" thymectomy--operative technique and early results », The Annals of Thoracic Surgery, vol. 78, no 2, , p. 404–409; discussion 409–410 (ISSN 1552-6259, PMID 15276485, DOI 10.1016/j.athoracsur.2004.02.021, lire en ligne, consulté le )
- N. Kitagawa, M. Shinkai, H. Take et K. Mochizuki, « Mediastinoscopic extended thymectomy for pediatric patients with myasthenia gravis », Journal of Pediatric Surgery, vol. 50, no 4, , p. 528–530 (ISSN 1531-5037, PMID 25840056, DOI 10.1016/j.jpedsurg.2014.08.012, lire en ligne, consulté le )
- Nicholas R. Hess, Inderpal S. Sarkaria, Arjun Pennathur et Ryan M. Levy, « Minimally invasive versus open thymectomy: a systematic review of surgical techniques, patient demographics, and perioperative outcomes », Annals of Cardiothoracic Surgery, vol. 5, no 1, , p. 1–9 (ISSN 2225-319X, PMID 26904425, PMCID 4740099, DOI 10.3978/j.issn.2225-319X.2016.01.01, lire en ligne, consulté le )
- Giulio Maurizi, Antonio D'Andrilli, Lorenzo Sommella et Federico Venuta, « Transsternal thymectomy », The Thoracic and Cardiovascular Surgeon, vol. 63, no 3, , p. 178–186 (ISSN 1439-1902, PMID 25503818, DOI 10.1055/s-0034-1396083, lire en ligne, consulté le )
- (en) Video-assisted thoracoscopic surgery or transsternal thymectomy in the treatment of myasthenia gravis? Zahid I, Sharif S, Routledge T, Scarci M, Interact Cardiovasc Thorac Surg. 2011 Jan;12(1):40-6. doi: 10.1510/icvts.2010.251041
- Pio Maniscalco, Nicola Tamburini, Francesco Quarantotto et William Grossi, « Long-term outcome for early stage thymoma: comparison between thoracoscopic and open approaches », The Thoracic and Cardiovascular Surgeon, vol. 63, no 3, , p. 201–205 (ISSN 1439-1902, PMID 25629459, DOI 10.1055/s-0034-1396594, lire en ligne, consulté le )
- René Horsleben Petersen, « Video-assisted thoracoscopic thymectomy using 5-mm ports and carbon dioxide insufflation », Annals of Cardiothoracic Surgery, vol. 5, no 1, , p. 51–55 (ISSN 2225-319X, PMID 26904432, PMCID 4740100, DOI 10.3978/j.issn.2225-319X.2016.01.02, lire en ligne, consulté le )
- (en) Frank C Detterbeck et Aiden M. Parsons, « Thymic tumors », Thoracic Surgery, vol. 77, no 5, , p. 1860-1869 (DOI 10.1016/j.athoracsur.2003.10.001, lire en ligne
 [PDF], consulté le )
[PDF], consulté le )
- G. Maggi, C. Casadio, A. Cavallo et R. Cianci, « Thymoma: results of 241 operated cases », The Annals of Thoracic Surgery, vol. 51, no 1, , p. 152–156 (ISSN 0003-4975, PMID 1985561, DOI 10.1016/0003-4975(91)90478-9, lire en ligne, consulté le )
- K. Nakahara, K. Ohno, J. Hashimoto et H. Maeda, « Thymoma: results with complete resection and adjuvant postoperative irradiation in 141 consecutive patients », The Journal of Thoracic and Cardiovascular Surgery, vol. 95, no 6, , p. 1041–1047 (ISSN 0022-5223, PMID 3374155, lire en ligne, consulté le )
- F. Venuta, E. A. Rendina, E. O. Pescarmona et T. De Giacomo, « Multimodality treatment of thymoma: a prospective study », The Annals of Thoracic Surgery, vol. 64, no 6, , p. 1585–1591; discussion 1591–1592 (ISSN 0003-4975, PMID 9436540, DOI 10.1016/s0003-4975(97)00629-2, lire en ligne, consulté le )
- Saina Attaran, David McCormack, John Pilling et Karen Harrison-Phipps, « Which stages of thymoma benefit from adjuvant chemotherapy post-thymectomy? », Interactive Cardiovascular and Thoracic Surgery, vol. 15, no 2, , p. 273–275 (ISSN 1569-9285, PMID 22552797, PMCID 3397733, DOI 10.1093/icvts/ivs133, lire en ligne, consulté le )
- Masatsugu Hamaji, Fumitsugu Kojima, Mitsugu Omasa et Takashi Sozu, « A meta-analysis of debulking surgery versus surgical biopsy for unresectable thymoma », European Journal of Cardio-Thoracic Surgery: Official Journal of the European Association for Cardio-Thoracic Surgery, vol. 47, no 4, , p. 602–607 (ISSN 1873-734X, PMID 25015950, DOI 10.1093/ejcts/ezu277, lire en ligne, consulté le )
- Kazuo Nakagawa, Kohei Yokoi, Jun Nakajima et Fumihiro Tanaka, « Is Thymomectomy Alone Appropriate for Stage I (T1N0M0) Thymoma? Results of a Propensity-Score Analysis », The Annals of Thoracic Surgery, vol. 101, no 2, , p. 520–526 (ISSN 1552-6259, PMID 26482784, DOI 10.1016/j.athoracsur.2015.07.084, lire en ligne, consulté le )
- Faiz Y. Bhora, David J. Chen, Frank C. Detterbeck et Hisao Asamura, « The ITMIG/IASLC Thymic Epithelial Tumors Staging Project: A Proposed Lymph Node Map for Thymic Epithelial Tumors in the Forthcoming 8th Edition of the TNM Classification of Malignant Tumors », Journal of Thoracic Oncology: Official Publication of the International Association for the Study of Lung Cancer, vol. 9, no 9 Suppl 2, , S88–96 (ISSN 1556-1380, PMID 25396317, DOI 10.1097/JTO.0000000000000293, lire en ligne, consulté le )
- (en) What is the role of lymph nodal metastases and lymphadenectomy in the surgical treatment and prognosis of thymic carcinomas and carcinoids? Viti A, Bertolaccini L, Terzi A Interact CardioVasc Thorac Surg (2014) 19 (6): 1054-1058 doi:10.1093/icvts/ivu281
- Benny Weksler, Arjun Pennathur, Jennifer L. Sullivan et Katie S. Nason, « Resection of thymoma should include nodal sampling », The Journal of Thoracic and Cardiovascular Surgery, vol. 149, no 3, , p. 737–742 (ISSN 1097-685X, PMID 25595379, DOI 10.1016/j.jtcvs.2014.11.054, lire en ligne, consulté le )
- (en) Gil I. Wolfe, Henry J. Kaminski, Inmaculada B. Aban, Greg Minisman, Hui-Chien Kuo, Alexander Marx, Philipp Ströbel, Claudio Mazia, Joel Oger, J. Gabriel Cea, Jeannine M. Heckmann, Amelia Evoli, Wilfred Nix, Emma Ciafaloni, Giovanni Antonini, Rawiphan Witoonpanich, John O. King, Said R. Beydoun, Colin H. Chalk, Alexandru C. Barboi, Anthony A. Amato, Aziz I. Shaibani, Bashar Katirji, Bryan R.F. Lecky, Camilla Buckley, Angela Vincent, Elza Dias-Tosta, Hiroaki Yoshikawa, Márcia Waddington-Cruz, Michael T. Pulley, Michael H. Rivner, Anna Kostera-Pruszczyk, Robert M. Pascuzzi, Carlayne E. Jackson, Guillermo S. Garcia Ramos, Jan J.G.M. Verschuuren, Janice M. Massey, John T. Kissel, Lineu C. Werneck, Michael Benatar, Richard J. Barohn, Rup Tandan, Tahseen Mozaffar, Robin Conwit, Joanne Odenkirchen, Joshua R. Sonett, Alfred Jaretzki, John Newsom-Davis et Gary R. Cutter, « Randomized Trial of Thymectomy in Myasthenia Gravis », New England Journal of Medicine, New England Journal of Medicine (NEJM\/MMS), vol. 375, no 6, , p. 511-522 (ISSN 0028-4793, DOI 10.1056/nejmoa1602489, lire en ligne).
- Yoshihisa Kadota, Hirotoshi Horio, Takeshi Mori et Noriyoshi Sawabata, « Perioperative management in myasthenia gravis: republication of a systematic review and a proposal by the guideline committee of the Japanese Association for Chest Surgery 2014 », General Thoracic and Cardiovascular Surgery, vol. 63, no 4, , p. 201–215 (ISSN 1863-6713, PMID 25608954, DOI 10.1007/s11748-015-0518-y, lire en ligne, consulté le )
- G. O. Skeie, S. Apostolski, A. Evoli et N. E. Gilhus, « Guidelines for treatment of autoimmune neuromuscular transmission disorders », European Journal of Neurology, vol. 17, no 7, , p. 893–902 (ISSN 1468-1331, PMID 20402760, DOI 10.1111/j.1468-1331.2010.03019.x, lire en ligne, consulté le )
- Yoshito Yamada, Shigetoshi Yoshida, Takekazu Iwata et Hidemi Suzuki, « Risk factors for developing postthymectomy myasthenia gravis in thymoma patients », The Annals of Thoracic Surgery, vol. 99, no 3, , p. 1013–1019 (ISSN 1552-6259, PMID 25633463, DOI 10.1016/j.athoracsur.2014.10.068, lire en ligne, consulté le )
- Kang-Ho Choi, Tai-Seung Nam, Seung-Han Lee et Myeong-Kyu Kim, « Preoperative pulmonary function is strongly related to myasthenic crisis after thymectomy », Neurology India, vol. 62, no 2, , p. 164–168 (ISSN 0028-3886, PMID 24823726, DOI 10.4103/0028-3886.132361, lire en ligne, consulté le )
- D. S. Younger et N. Raksadawan, « Medical therapies in myasthenia gravis », Chest Surgery Clinics of North America, vol. 11, no 2, , p. 329–336 (ISSN 1052-3359, PMID 11413759, lire en ligne, consulté le )
- P. E. Krucylak et K. S. Naunheim, « Preoperative preparation and anesthetic management of patients with myasthenia gravis », Seminars in Thoracic and Cardiovascular Surgery, vol. 11, no 1, , p. 47–53 (ISSN 1043-0679, PMID 9930712, DOI 10.1016/s1043-0679(99)70019-5, lire en ligne, consulté le )
- Shunsuke Endo, Tsutomu Yamaguchi, Noriko Saito et Shinichi Otani, « Experience with programmed steroid treatment with thymectomy in nonthymomatous myasthenia gravis », The Annals of Thoracic Surgery, vol. 77, no 5, , p. 1745–1750 (ISSN 0003-4975, PMID 15111178, DOI 10.1016/j.athoracsur.2003.10.039, lire en ligne, consulté le )
- E. Arsura, N. G. Brunner, T. Namba et D. Grob, « High-dose intravenous methylprednisolone in myasthenia gravis », Archives of Neurology, vol. 42, no 12, , p. 1149–1153 (ISSN 0003-9942, PMID 4062612, DOI 10.1001/archneur.1985.04060110031011, lire en ligne, consulté le )
- (en) Kameron A. Kooshesh, Brody H. Foy, David B. Sykes et Karin Gustafsson, « Health Consequences of Thymus Removal in Adults », New England Journal of Medicine, vol. 389, no 5, , p. 406–417 (ISSN 0028-4793 et 1533-4406, PMID 37530823, PMCID PMC10557034, DOI 10.1056/NEJMoa2302892, lire en ligne, consulté le )